BEBERAPA SOAL UTBK KIMIA 2019 SERTA PEMBAHASANYA
APJUL GULTOM, S.Pd
UNTUK SOAL NOMOR 1 S/D 3
Diketahui data :
Nomor atom
|
Simbol
|
Nomor massa
|
7
|
M
|
14
|
14
|
L
|
28
|
15
|
Z
|
31
|
16
|
Q
|
32
|
17
|
X
|
36
|
1.
Pasangan atom yang dalam
tabel periodik unsur terletak dalam satu golongan...
(A) M dan L
(B) M dan Q
(C) L dan Z
(D) Z dan Q
(E) M dan Z
PEMBAHASAN : E
7M : 2-5 →periode 2, golongan VA
14L: 2-8-4 →periode 3, golongan IVA
15Z: 2-8-5 →periode 3, golongan VA
16Q: 2-8-6 →periode 3, golongan VIA
17X: 2-8-7 →periode 3, golongan VIIA
Segolongan memiliki elektron
valensi sama yaitu M dan Z terletak dalam golongan VA (Nitrogen)
2.
Atom yang memiliki jari-jari
terbesar adalah..
(A) M
(B) L
(C) Z
(D) Q
(E) X
PEMBAHASAN : B
7M : 2-5 →periode 2, golongan VA
14L: 2-8-4 →periode
3, golongan IVA
15Z: 2-8-5 →periode 3, golongan VA
16Q: 2-8-6 →periode 3, golongan VIA
17X: 2-8-7 →periode 3, golongan VIIA
Jari jari terbesar
pada hal ini kita lihat dari periode terbesar dengan golongan terkecil yaitu
unsur L periode 3, golongan IVA
3.
Molekul unsur diatomik dari
ke-lima atom tersebut adalah..
(A) M2 dan L2
(B) L2 dan Z2
(C) Z2 dan Q2
(D) Q2 dan X2
(E) M2 dan X2
PEMBAHASAN : E
Beberapa unsur yang dapat membentuk unsur diatomik
adalah : H2, N2, O2, F2, Cl2,
Br2, I2, dan lain-lain.
7M : 2-5 → unsur N membentuk N2
14L: 2-8-4 → unsur Si
15Z: 2-8-5 → unsur P membentuk P4
16Q: 2-8-6 → unsur S membentuk S8
17X: 2-8-7 → unsur Cl membentuk Cl2
4.
Air dipegunungan akan lebih
cepat mendidih dibanding dengan di pantai
SEBAB
Tekanan udara dipegunungan lebih tinggi dibanding tekanan udara di
pantai
PEMBAHASAN : C
Makin ke puncak gunung maka tekanan udara
turun sehingga suatu cairan akan mendidih lebih cepat dibandingkan dengan kaki
gunung
5.
Sapi dapat memanfaatkan
rumput sebagai sumber makanan, karena sapi mempunyai enzim..
(A) Glukosidae
(B) Amilase
(C) Maltase
(D) Selulase
(E) Silanase
SOAL
UNTUK NOMOR 6 S/D 8
Dalam suasana asam kalium iodat dapat mengoksidasi
asam arsenat menurut reaksi redoks sebagai berikut :
KIO3(aq) + 3H3AsO3(aq)
→ 3H3AsO4(aq) + KI(aq).
Dalam suatu reaksi digunakan 60 ml larutan KIO3
0,02 M dan
40 ml larutan H3AsO3 yang didapat dari pengenceran 6 ml
larutan H3AsO3 0,6 M.
6. Jumlah
elektron yang terlibat untuk setiap mol KIO3 adalah..
(A) 1
(B) 2
(C) 3
(D) 5
(E) 6
PEMBAHASAN : E
Kita setarakan
reaksinya :
IO3-
+ 6H+ + 6e → I- + 3H2O
Maka mol e = 6/1 x
mol IO3-
= 6/1 x 1
= 6 mol
7. Konsentrasi
larutan H3AsO3 yang didapat dari hasil pengenceran
adalah...
(A) 0,01 M
(B) 0,02 M
(C) 0,03 M
(D) 0,06 M
(E) 0,09 M
PEMBAHASAN : E
Pengenceran untuk H3AsO3
V1 x M1 = V2 x
M2
6 x 0,6 = 40 x M2
M2 =
3,6/40
M2 =
0,09 M
8.
Jika reaksi tersebut berlangsung
stoikiometris (sempurna), konsentrasi KI dalam larutanya adalah..
(A) 0,002 M
(B) 0,012 M
(C) 0,020 M
(D) 0,040 M
(E) 0,060 M
PEMBAHASAN : B
mmol KIO3
= 60 x 0,02 = 1,2 mmol
mmol H3AsO3 = 6 x 0,6 = 3,6 mmol
KIO3(aq)
+ 3H3AsO3(aq) → 3H3AsO4(aq) + KI(aq
M: 1,2 mmol
3,6 mmol - -
B: 1,2
mmol 3,6 mmol 3,6 mmol 1,2 mmol
S: - - 3,6 mmol 1,2 mmol
Maka [KI] = mmol/vol. total
= 1,2/(60+40)
= 0,012 M
9.
Atom pusat Cl dalam senyawa ClF3
dikelilingi oleh 5 domain pasangan elektron yang terdiri dari 3 domain
pasangan elektron ikatan dan 2 domain pasangan elektron bebas yang tidak
berikatan. Geometri molekul ClF3 adalah...[17Cl dan 9F]
(A) Bentuk V
(B) Bentuk T
(C) Planar
segitiga
(D) Jungkat-jungkit
(E) Segiempat
datar
PEMBAHASAN : B
PEI
|
PEB
|
RAMALAN
|
BENTUK
|
2
|
-
|
AX2
|
Linier
|
3
|
-
|
AX3
|
Segitiga
datar/ planar
|
4
|
-
|
AX4
|
Tetrahedral
|
3
|
1
|
AX3E
|
Segitiga
piramida
|
2
|
2
|
AX2E2
|
Bentuk V
(bengkok) / bent
|
5
|
-
|
AX5
|
Segitiga
bipiramida
|
4
|
1
|
AX4E
|
Seesaw /
jungkat-it
|
3
|
2
|
AX3E2
|
Bentuk T
|
2
|
3
|
AX2E3
|
Linier
|
6
|
-
|
AX6
|
Oktahedral
|
5
|
1
|
AX5E
|
Segiempat
piramida
|
4
|
2
|
AX4E2
|
Segiempat
datar /bujur sangkar
|
10. Reduksi
metilisopropilketon oleh LiAlH4 menghasilkan..
(A) 3-metil-2-butanol
(B) 3-metilisopropilpropanol
(C) 2-metil-3-hidroksibutana
(D) Isobutanol
(E) Isopentanol
PEMBAHASAN : A
Reduksi dari keton akan menghasilkan alkohol sekunder
O CH3 OH CH3
//
/ / /
CH3 - C - CH – CH3 + LiAlH4
→ CH3 - CH - CH – CH3
3-metil-2-butanon 3-metil-2-butanol
SOAL
UNTUK NOMOR 11 S/D 13
Sebanyak 50 ml larutan SO2 dititrasi
dengan larutan KBrO4 0,1 M menurut reaksi :
KBrO4
+ 4SO2 + 4H2O → 4H2SO4 + KBr
Titik eqivalen tercapai saat volume KBrO4
yang digunakan sebanyak 50 ml.
11. Konsentrasi
SO2 dalam larutan adalah..
(A) 0,1 M
(B) 0,2 M
(C) 0,3 M
(D) 0,4 M
(E) 0,5 M
PEMBAHASAN : D
KBrO4
+ 4SO2 + 4H2O → 4H2SO4 + KBr
Mol SO2 = 4 x mol KBrO4
M x 50 = 4 x
50 x 0,1
M =
0,4
12. Jumlah
mol elektron yang terlibat dalam reaksi di atas..
(A) 0,02 mol
(B) 0,04 mol
(C) 0,08 mol
(D) 0,10 mol
(E) 0,12 mol
PEMBAHASAN : B
KBrO4 8H+ + 8e → KBr +4H2O
Mol e = 8 x mol KBrO4
Mol e = 8 x (M x V)
Mol e = 8 x 0,1 x 50.10-3
Mol e = 0,04 mol
13. pH
larutan setelah titrasi adalah..
(A) 4
(B) 4 - log 2
(C) 1 – 2 log 2
(D) 5
(E) 6
PEMBAHASAN : C
KBrO4
+ 4SO2 + 4H2O → 4H2SO4 + KBr
Mol H2SO4 = 4 x mol KBrO4
Mol H2SO4 = 4 x 0,1 x 50.10-3
Mol H2SO4 = 0,02 mol
[H2SO4]
= 0,02/vol total
[H2SO4]
= 0,02/0,1
[H2SO4]
= 0,2 M
[H+]
= 0,2 x 2
= 4.10-1
pH
= - log 4.10-1
= 1 – log 4
= 1 – 2
log 2
14. Disediakan
tabel :
Nomor
atom
|
Simbol
|
Nomor
massa
|
3
|
X
|
7
|
11
|
Y
|
23
|
19
|
Z
|
39
|
37
|
Q
|
86
|
55
|
R
|
133
|
Jika n
adalah kuantum dari kulit terluar, maka konfigurasi elektron kulit terluar
kelima atom pada keadaan dasar adalah...
(A) ns1
(B) ns2
(C) ns2, np1
(D) ns2, np2
(E) ns2, np3
PEMBAHASAN : A
Golongan I A (alkali) akan memiliki konfigurasi yang
berakhir pada ns1. Berada pada blok
s
3X : 2, 1
11Y: 2, 8, 1
19Z: 2, 8, 8, 1
37Q: 2, 8, 18, 8, 1
55R: 2, 8, 18, 18, 8, 1
UNTUK NOMOR 15 S/D 17
Disediakan tabel :
Nomor
atom
|
Simbol
|
Nomor
massa
|
13
|
M
|
27
|
14
|
Q
|
28
|
15
|
R
|
31
|
16
|
X
|
32
|
17
|
Y
|
36
|
15. Atom
yang memiliki elektron berpasangan paling banyak..
(A) M
(B) D
(C) R
(D) X
(E) Y
PEMBAHASAN : E
13M : [Ne] 3s2 3p1
14Q : [Ne] 3s2 3p2
15R : [Ne] 3s2 3p3
16X : [Ne] 3s2 3p4
17Y : [Ne] 3s2 3p5
Orbital p memiliki 3 kotak yang diisi electron
maksimum sebesar 6.
13M : 1 elektron tunggal
14Q : 2 elektron tunggal
15R : 3 elektron tunggal
16X : 2 elektron tunggal dan 1 pasang elektron
17Y : 1 elektron tunggal dan 2 pasang elektron
16. Atom
yang oksidanya merupakan basa adalah..
(A) M
(B) Q
(C) R
(D) X
(E) Y
PEMBAHASAN : A
Umumnya logam utama berakhiran pada elektron valensi
1, 2 dan 3 atau golongan I A, IIA, IIIA. Kecuali :
1. 1H
2. 4Be
3. 5B
13M : [Ne] 3s2 3p1→ golongan III
A
14Q : [Ne] 3s2 3p2→ golongan IV
A
15R : [Ne] 3s2 3p3→ golongan VA
16X : [Ne] 3s2 3p4→ golongan VI
A
17Y : [Ne] 3s2 3p5→ golongan VII
A
Oksida logam (oksida basa) artinya logam yang
bergabung dengan oksigen. Maka pilihan adalah unsur M
· Oksida non logam (oksida asam) artinya non logam yang
bergabung dengan oksigen
·
Oksida amfoter artinya oksida yang mampu membentuk
asam dan basa
·
Oksida indifferent adalah oksida yang tidak bisa
membentuk asam ataupun basa
17. Senyawa ionik dengan Y yang paling mungkin
adalah...
(A) M2Y
(B) XY
(C) Q3Y
(D) MY3
(E) RY2
PEMBAHASAN : D
Senyawa ionik adalah senyawa yang dapat membentuk atau
terbentuk dari kation dan anion. Ikatan ionik terbentuk dari logam dan non
logam. 17Y : [Ne] 3s2 3p5→ golongan VII A. Unsur Y adalah
unsur non logam, maka untuk membentuk senyawa ion, unsur Y harus berikatan
dengan unsur logam yaitu unsur M.
Proses pembentukanya ;
17Y : [Ne] 3s2 3p5→ menangkap 1
e : Y-
13M : [Ne] 3s2 3p1→ melepas 3 e
: M3+
Jadi :
M3+ + Y- → MY3
UNTUK NOMOR 18 S/D 20
Nomor atom
|
Simbol
|
Nomor massa
|
4
|
M
|
9
|
8
|
L
|
16
|
9
|
Z
|
19
|
12
|
Q
|
24
|
20
|
X
|
40
|
18. Pasangan
atom yang dalam tabel periodik terletak dalam satu golongan...
(A) M dan L
(B) X dan Q
(C) Q dan Z
(D) Z dan M
(E) Z dan L
PEMBAHASAN : B
4M : 2, 2→golongan II A
8L : 2, 6 → golongan VI A
9Z : 2, 7 → golongan VII A
12Q : 2, 8, 2 → golongan II A
20X : 2, 8, 8, 2 → golongan II A
Segolongan berarti
memiliki jumlah elektron valensi sama, yaitu M, Q, X sama sama berada di
golongan alkali tanah (IIA)
19. Atom
yang mempunyai energi ionisasi pertama yang paling kecil adalah...
(A) L
(B) M
(C) Q
(D) X
(E) Z
PEMBAHASAN : D
· Dalam satu periode dari kiri ke kanan, enenrgi
ionisasi cenderung naik. Kecuali II A > III A dan VA > VIA
· Dalam satu golongan dari atas ke bawah energi ionisasi
menurun karena jari – jari atom meningkat sehingga gaya Tarik inti terhadap elektron
terluar makin kecil
4M : 2, 2 →golongan
II A, periode 2
8L : 2, 6 → golongan VI A, periode 2
9Z : 2, 7 → golongan VII A, periode 2
12Q : 2, 8, 2 → golongan II A,
periode 3
20X : 2, 8, 8, 2 → golongan II A, periode 4
Dari data di atas, maka energi ionisasi terkecil kita ambil dari golongan terkecil dan periode terbesar. Maka energi ionisai terkecil adalah unsur X
Dari data di atas, maka energi ionisasi terkecil kita ambil dari golongan terkecil dan periode terbesar. Maka energi ionisai terkecil adalah unsur X
20. Senyawa
dengan L yang bersifat basa kuat adalah..
(A) M
(B) L
(C) Z
(D) W
(E) X
PEMBAHASAN : E
Dalam 1 golongan dari atas ke bawah sifat basa makin
kuat. Unsur yang dapat membentuk basa adalah logam. Basa I A > II A. maka
basa terkuat adalah unsur yang terbentuk dari X
UNTUK NOMOR 21 S/D 23
Terdapat reaksi : HNO3 + 3HCl → Cl2
+ NOCl + 2H2O. Digunakan larutan pekat HCl 9 M dan 20 ml larutan HNO3
6 M yang diperoleh dari pengenceran HNO3 yang lebih pekat.
21. Jika 1
mol HNO3 habis bereaksi, maka jumlah elektron yang terlibat dalam
reaksi adalah...
(A) 1 mol
(B) 2 mol
(C) 3 mol
(D) 4 mol
(E) 5 mol
PEMBAHASAN : B
HNO3
→ NOCl . kita cari perubahan biloks unsur N
+5 +3
Maka perubahan bilangan oksidasi (PBO) unsur N adalah
2.
Mol e = PBO x mol zat
Mol e = 2 x 1
Mol e = 2 mol
22. Larutan
HNO3 yang digunakan pada reaksi tersebut diperoleh dari pengenceran
larutan HNO3 pekat 12 M. Volume HNO3 pekat yang
diperlukan adalah...
(A) 3 ml
(B) 5 ml
(C) 7 ml
(D) 10 ml
(E) 12 ml
PEMBAHASAN : D
Pengenceran menggunakan rumus :
V1 x M1 = V2 x M2
V1 x 12 = 20 x
6
V1 =
10 ml
23. Jika gas
Cl2 yang dihasilkan 0,12 mol dan semua reaktan habis bereaksi,
volume HCl yang bereaksi adalah...
(A) 10 ml
(B) 20 ml
(C) 30 ml
(D) 40 ml
(E) 60 ml
PEMBAHASAN : D
HNO3 + 3HCl → Cl2 + NOCl + 2H2O
Mol HCl = 3 x mol Cl2
Mol HCl = 3 x 0,12
Mol HCl = 0,36 mol
Volume HCl = mol/ M
Volume HCl = 0,36/9
Volume HCl =
0,04 L
Volume HCl = 40
ml
24. Geometri
molekul SO2 adalah...[16S, 8O]
(A) Linier
(B) Sigitiga
planar
(C) Bentuk T
(D) Bentuk V
(E) Segitiga
piramida
PEMBAHASAN : D
PEI
|
PEB
|
RAMALAN
|
BENTUK
|
2
|
-
|
AX2
|
Linier
|
3
|
-
|
AX3
|
Segitiga
datar/ planar
|
2
|
1
|
AX2E
|
Bentuk V
|
4
|
-
|
AX4
|
Tetrahedral
|
3
|
1
|
AX3E
|
Segitiga
piramida
|
2
|
2
|
AX2E2
|
Bentuk V
(bengkok) / bent
|
5
|
-
|
AX5
|
Segitiga
bipiramida
|
4
|
1
|
AX4E
|
Seesaw / jungkat-it
|
3
|
2
|
AX3E2
|
Bentuk T
|
2
|
3
|
AX2E3
|
Linier
|
6
|
-
|
AX6
|
Oktahedral
|
5
|
1
|
AX5E
|
Segiempat
piramida
|
4
|
2
|
AX4E2
|
Segiempat
datar /bujur sangkar
|
Untuk mencari Pasangan electron bebas (PEB) :
PEB = (EV atom pusat - jumlah elektron terpakai –
muatan)/2
EV = electron valensi atom pusat
Pada senyawa SO2 atom pusat adalah S (nomor
atom 16)
16S = 2, 8, 6 ( elektron valensi = 6)
Oksigen yang terikat memakai 2 elektron setiap atom O
Maka :
PEB = (6 – 2x2 – 0)/2
PEB = 1
Domain PEI = 2
Sehingga berbentuk AX2E (bentuk V)
25. Apa
tujuan penambahan zat aditif pada bensin? (Jawab : untuk menaikkan bilangan
oktan atau meningkatkan kualitas bensin)
26. Ikan di
lautan antartika dapat bertahan hidup pada temperatur – 20C
karena...
(A) Viskositas
darah ikan lebih tinggi dibandingkan dengan air lautan
(B) Sisik
ikan menjaga temperatur tubuh ikan
(C) Konsentrasi zat terlarut pada darah ikan lebih tinggi dibandingkan
konsentrasi zat terlarut dalam air lautan
(D) Gerak
ikan menyebabkan kestabilan tubuh ikan
(E) Ikatan
hidrogen dalam darah ikan lebih tinggi dibanding dalam air laut
27. Baterai
Nikel-Cadmium banyak digunakan pada peralatan elektronik. Baterai ini
menggunakan elektroda baja dan elektrolit KOH. Jika diketahui :
E0Cd2+/Cd = - 0,40 V
E0Ni2+/Ni = - 0,25 V
Pernyataan yang benar ...
(A) Pada
anoda terjadi reaksi Cd2+ menjadi Cd
(B) Pada
katoda terjadi reaksi Ni menjadi Ni2+
(C) Pada anoda terbentuk Cd(OH)2
(D) Pada
katoda terbentuk Ni(OH)2
(E) Ion OH-
mengalami oksidasi
PEMBAHASAN : C
E0Cd2+/Cd = - 0,40 V →E0 kecil sebagai (Anoda
/ Oksidasi / kutub negatif / Larut)
E0Ni2+/Ni = - 0,25 V →E0 besar sebagai (Katoda / Reduksi / kutub
positif / Mengendap)
Reaksi :
Setengah reduksi
(KATODA) : Ni2+ + 2e → Ni
Setengah
oksidasi (ANODA) : Cd → Cd2+
+ 2e
Reaksi sel : Ni2+ + Cd → Cd2+ + Ni
Maka pada anoda
terbentuk ion Cd2+ selanjutnya bergabung dengan ion OH-
dari larutan membentuk Cd(OH)2
28. Reaksi
yang menghasilkan alkohol sekunder adalah..
(A) Reduksi
asetaldehid
(B) Reduksi
asetil aseton
(C) Reduksi metil etil keton
(D) Oksidasi
etana
(E) Oksidasi
asetilklorida
PEMBAHASAN : C
Reduksi dari keton akan menghasilkan alkohol sekunder
Mislnya :
O OH
// /
CH3 - C – CH2 – CH3 +
LiAlH4 → CH3 - CH – CH2 – CH3
Metil etil
keton 2-butanol
29. Ikatan
antar monomer dalam amilum adalah...
(A) Peptida
(B) Fosfodiester
(C) Glikosida
(D) Amida
(E) Ester
PEMBAHASAN : C
Ikatan glikosida menggabungkan monomer monomer amilosa untuk membentuk
polimer berupa amilum. Jadi polimer adalah senaywa yang besar dan terbentuk dari
hasil penggabungan sejumlah unit molekul kecil dari monomer - monomernya.
UNTUK SOAL 30-32
Diketahui reaksi : 3HOCl
+ NaI → NaIO3 + 3HCl. Dalam suatu
larutan NaI 0,05 M dan 100 ml larutan HOCl hasil pengenceran dari 5 ml larutan
HOCl 3 M.
30. Jumlah
mol elektron yang terlibat untuk setiap mol NaI adalah..
(A) 3 mol
(B) 4 mol
(C) 5 mol
(D) 6 mol
(E) 7 mol
PEMBAHASAN : D
NaI + 3H2O → NaIO3 + 6H+ + 6e
Mol e = 6 x mol NaI
Mol e = 6 x 1
Mol e = 6 mol
31. Konsentrasi
larutan HOCl yang diperoleh sebagai hasil pengenceran adalah..
(A) 0,03 M
(B) 0,06 M
(C) 0,15 M
(D) 0,30 M
(E) 0,50 M
PEMBAHASAN : C
Pengenceran menggunakan rumus :
V1 x M1 = V2 x M2
5 x 3 = 100 x M2
M2 = 0,15 M
32. Jika
reaksi redoks tersebut berlangsung secara stoikiometris dan sempurna,
konsentrasi HCl yang didapat dalam larutan adalah...
(A) 0,015 M
(B) 0,025 M
(C) 0,030 M
(D) 0,050 M
(E) 0,075 M
PEMBAHASAN : E
3HOCl + NaI → NaIO3 + 3HCl
Untuk reasi berlangsung semprna maka :
mmol NaI = 1/3 x mol HOCl
mmol NaI = 1/3 x ( 5 x 3)
mmol NaI = 5 mmol
Kita hitung dahulu volume NaI dalam larutan. Volume
NaI yang dibutuhkan untuk berlansung sempurna adalah :
Volume NaI = mmol : M
Volume NaI = 5 : 0,05
Volume NaI = 100 ml
mmol HCl = 3 x mmol NaI
mmol HCl = 3 x 5
mmol HCl = 15 mmol
[HCl] = mmol : (volume total)
[HCl] = 15 : (100 + 100)
[HCl] = 15 : 200
[HCl] = 0,075 M
UNTUK SOAL 33-35
Sebanyak 25 ml larutan metilamina (CH3NH2)
0,04 M (kb = 4x10-4) dititrasi dengan larutan HCl 0,02 M.
33. pH
larutan CH3NH2 sebelum titrasi adalah..
(A) 3 – 2
log 2
(B) 5 + 2
log 4
(C) 9 + 2
log 4
(D) 10 – 2
log 2
(E) 11 + 2 log 2
PEMBAHASAN : E
Sebelum dittitrasi ( sebelum dicampur dengan HCl),
maka kita hitung dari pH basa lemah :
[OH-] = √kb x Mb
[OH-] = √4.10-4 x 4.10-2
[OH-] = 4 x 10-3
pOH = - log 4 x 10-3
pOH = 3 – log 4
maka
pH = 14 – ( 3 – log 4)
pH = 11 + 2 log 2
34. pH
larutan setelah dititrasi dengan 25 ml larutan HCl adalah..
(A) 6 – log
2
(B) 6 + log
2
(C) 8 – log 2
(D) 8 + log
2
(E) 10 + 2 log 2
35. Setelah
penambahan 55 ml larutan HCl, campuran diencerkan dengan air sampai 100 ml.
Berapakah pH nya..
(A) 2
(B) 3
(C) 4
(D) 5
(E) 6
UNTUK SOAL 36-38
Diketahui reaksi : 6H+
+ 3SO32- + 2MnO4- → 3SO42-
+ 2Mn2+ + 3H2O.
Dalam suatu reaksi digunakan 100 ml larutan H2SO4
0,1 M dan 100 ml KMnO4 yang didapat dari pengenceran 5 ml KMnO4
2 M
36. Elektron
yang terlibat untuk setiap 5 mol SO32- adalah..
(A) 2 mol
(B) 5 mol
(C) 7 mol
(D) 10 mol
(E) 14 mol
PEMBAHASAN : D
SO32- → SO42-
SO32- + H2O→ SO42-
SO32- + H2O→ SO42- + 2H+
SO32- + H2O→ SO42- + 2H+ + 2e
Maka :
Mol e = 2 x mol SO32-
Mol e = 2 x 5
Mol e = 10 mol
37. Konsentrasi
larutan MnO4- hasil pengenceran adalah..
(A) 0,01 M
(B) 0,05 M
(C) 0,10 M
(D) 0,15 M
(E) 0,20 M
PEMBAHASAN : C
Pengenceran :
V1 x M1 = V2 x M2
5 x 2 = 100 x M2
M2 = 0,1 M
38. Baterai
NiCad merupakan baterai komersil yang bisa diisi ulang. Baterai ini menggunakan
Nikel (IV) oksida hidroksida NiO(OH)2 dan
logam Cd sebagai elektroda dengan KOH sebagai elektrolit. Pernyataan yang benar
adalah..
(A) NiO(OH)2
sbagai anoda
(B) Massa logam Cd akan berkurang seiring pemakaian baterai
(C) Massa
NiO(OH)2 akan bertambah seiring pemakaian
baterai
(D) Elektron
mengalir dari NiO(OH)2 ke logam Cd
(E) Saat
pemakaian baterai, ion OH- akan diubah menjadi H2O
PEMBAHASAN : B
·
E0 kecil sebagai (Anoda / Oksidasi / kutub
negatif / Larut)
Larut berarti
elektrodanya akan menipis atau massanya akan berkurang
·
E0 besar sebagai (Katoda / Reduksi / kutub
positif / Mengendap)
Mengendap
berarti massanya akan makin bertambah
Reaksi yang terjadi :
Cd(s) + NiO2(s)
+ 2H2O(l) → Ni(OH)2 (s) +
Cd(OH)2(s) Esel =
1,4 Volt
39. Ditepi
pantai air mendidih pada suhu 1000C, sedangkan di pegunungan air
mendidih kurang dari 1000C, karena..
(A) Di
pegunungan ikatan hidrogen antar molekul air lebih rendah
(B) Di
tempat yang lebih tinggi, bentuk molekul air berubah
(C) Udara di
pegunungan relatif lebih dingin
(D) Tekanan udara dipegunungan lebih rendah dari 1 atm
(E) Di
pegunungan lebih tinggi dari pada di pantai
PEMBAHASAN : D
Makin ke puncak gunung maka tekanan udara
turun sehingga suatu cairan akan mendidih lebih cepat dibandingkan dengan kaki
gunung
40. Batuan
yang mengandung Ba, Na, K, Ca, dan Mg dimasukkan ke dalam larutan HCl pekat
kemudian ditambahkan padatan KOH. Endapan pertama kali yang terbentuk adalah..
(A) Ba
(B) Na
(C) K
(D) Ca
(E) Mg
PEMBAHASAN : E
·
Logam Ba, Na,
K, Ca, dan Mg jika bereaksi dengan HCl kan membentuk garam dan gas
hydrogen
·
Garam tersebut
selanjutnya akan bereaksi dengan KOH membentuk garam 2 dan basa 2. Basa yang
terbentuk adalah basa dari Ba, Na, K, Ca, dan Mg
·
Sifat basa dalam satu golongan dari atas ke bawah
makin besar, berarti basa paling lemah adalah Mg
·
Golongan IA sifat basanya lebih kuat dari IIA
·
Maka basa paling lemah akan larut paling lama atau
mudah mengendap
UNTUK SOAL 41-43
Hidrazin adalah senyawa anorganik dengan rumus kimia
N2H4. Berbau seperti amonia, hidrazin sangat berbau dan
beracun, karena sifatnya yang tidak stabil
kecuali ditangani dalam larutan. Sebanyak 20 ml larutan hidrazin ( kb = 2.10-6
) 0,02 M dititrasi dengan larutan HCl 0,02 M
41. pH
larutan hidrazin sebelum titrasi adalah...
(A) 2 – log
4
(B) 4 – log
2
(C) 6 + log
2
(D) 8 + log
2
(E) 10 + log 2
PEMBAHASAN : E
pH sebelum titrasi berarti sebelum bereaksi dengan
HCl. Maka pH yang dimaksud adalah pH N2H4. N2H4
adalah basa lemah
[OH-] = √kb x Mb
[OH-] = √2.10-6 x 2.10-2
[OH-] = 2 x 10-4
pOH = - log 2 x 10-4
pOH = 4 – log 2
pH = 10 + log 2
42. pH
larutan setelah penambahan 10 ml HCl adalah
(A) 2 – log
4
(B) 4 – log
2
(C) 6 + log
2
(D) 8 + log 2
(E) 10 + log
2
PEMBAHASAN : D
Cari mmol mula- mula dari N2H4
dan HCl
mmol N2H4 = 20 x 0,02 = 0,4 mmol
mmol HCl = 10 x 0,02 = 0,2 mmol
N2H4
+ HCl →N2H5Cl
M: 0,4
0,2 -
B: 0,2 0,2 0,2
S: 0,2 - 0,2
Yang tersisa adalah basa lemah dengan garamnya, maka
kita gunakan penyangga basa.
[OH-] = kb x mol N2H4/mol
N2H5Cl
[OH-] = 2.10-6 x (0,2/0,2)
[OH-] = 2.10-6
pOH = - log 2.10-6
pOH = 6 – log 2
pH = 8 + log 2
43. pH
larutan pada titik eqivalen adalah..
(A) 5 – log
2
(B) 5 + log
2
(C) 5 + ½ log 2
(D) 5 - log
4
(E) 5 – ½
log 4
PEMBAHASAN : C
Untuk menentukan pH pada titik eqivalen berarti anatara
N2H4 dengan HCl tidak ada zat yang tersisa. Semuanya
habis bereaksi. Maka yang tersisa
hanyalah garam, sehingga rumus yang kita gunakan adalah rumus hidrolisis garam
yang bersifat asam (garam dari asam kuat dan basa lemah).
mmol N2H4 = 20 x 0,02 = 0,4 mmol
N2H4
+ HCl →N2H5Cl
0,4mmol
Pada saat titik eqivalen maka mmol HCl = mmol N2H4
= 0,4 mmol
Jadi volume HCl = mmol/ml total
volume
HCl = 0,4/0,02
volume
HCl = 20 ml
kita hitung konsentrasi garam yang terbentuk,
mmol N2H5Cl = mmol HCl = mmol N2H4
= 0,4 mmol
jadi [N2H5Cl] = 0,4/(20+20)
[N2H5Cl]
= 0,4/40
[N2H5Cl]
= 0,01 M
44. Diketahui
:
Maka ∆H reaksi
N2 + O2 → NO2 pada
tabel adalah..
(A) + 16,59
kJ/mol
(B) – 16,59
kJ/mol
(C) + 33,18 kJ/mol
(D) – 33,18
kJ/mol
(E) + 66,36
kJ/mol
PEMBAHASAN : C
Maka ∆H = + 90,25 – 57,07
Maka ∆H = + 33,18 kJ/mol
45. Pada
temperatur tertentu, tahap penentu reaksi adalah (Dari soal no 44)...
(A) NO2
→ NO +
N2
(B) NO
→
N2 +
O2
(C) NO +
O2 → NO2
(D)
N2 +
O2
→ NO
(E) 2NO + O2
→ 2NO2
PEMBAHASAN : D
Tahap penentu reaksi kita ambil dari reaksi paling
lambat. Reaksi paling lambat berarti memiliki energy aktifasi paling besar.
(energy aktifasi dihitung dari reaktan ke puncak)
UNTUK SOAL 46-48
Nomor atom
|
Simbol
|
Nomor massa
|
5
|
X
|
11
|
6
|
Y
|
12
|
7
|
Z
|
14
|
8
|
Q
|
16
|
9
|
R
|
19
|
46. Atom
dengan ukuran jari-jari terkecil adalah..
(A) X
(B) Y
(C) Z
(D) Q
(E) R
PEMBAHASAN : E
5X : 2, 3
6Y : 2, 4
7Z : 2, 5
8Q : 2, 6
9R : 2, 7
Semua unsur tersebut berada pada periode 2, dan
golongan yang berbeda. Dalam satu periode, jari-jari terkecil kita lihat dari
proton paling banyak, yaitu unsur R dengan proton sebesar 9.
47. Atom
yang dalam senyawanya cenderung bermuatan – 2 adalah...
(A) X
(B) Y
(C) Z
(D) Q
(E) R
PEMBAHASAN : D
Untuk menentukan muatan suatu unsur, maka :
1. Jika electron valensi berakhir di 1, 2, 3 maka cenderung akan melepas
electron sebesar electron valensinya
2. Jika electron valensi berakhir pada 4, 5, 6, 7 maka cenderung menangkap
electron sampai 8
3. Jika electron valensinya 8 maka disebut stabil
Jadi Unsur 8Q : 2, 6 memiliki electron valensi 6 sehingga
menangkap 2 elektron supaya 8
48. Jika
kelima atom tersebut dimisalkan dengan M, atom yang dapat membentuk molekul MCl3
adalah...
(A) X dan Y
(B) X dan Z
(C) Y dan Q
(D) Z dan R
(E) Q dan R
PEMBAHASAN : B
5X : 2, 3→ unsur B
6Y : 2, 4→ unsur C
7Z : 2, 5→ unsur N
8Q : 2, 6→ unsur O
9R : 2, 7→ unsur F
Yang dapat membentuk MCl3 adalah BCl3
dan NCl3
49. Pak
burhan berprofesi sebagai penggali sumur. Ia diketahui meninggal mendadak
ketika sedang menggali sumur pada kedalaman tertentu. Kemungkinan terkuat
penyebab meninggalnya pak burhan adalah..
(A) Adanya gas beracun dalam sumur
(B) Banyak gas CO
(C) Kekurangan
O2
(D) Tingginya
temperature dalam sumur
(E) Gangguan
mahluk halus
50. Lintah
adalah salah satu hewan pengganggu yang sangat banyak terdapat di kaki gunung
ciremai. Lintah banyak tersebar di tepian sungai di sekitar tersebut. Salah
satu cara efektif untuk mengatasi lintah yang biasa mengganggu para pendaki
gunung biasanya dilakukan dengan jalan menaburkan garam.
Konsep kimia yang dapat menggambarkan kejadian tersebut adalah...
(A) Titik
didih
(B) Tekanan osmosis
(C) Titik
beku
(D) Tekanan
uap
(E) Kekerasan
PEMBAHASAN : B
Osmosis adalah perpindahan pelarut dari konsentrasi
rendah ke konsentrasi tinggi melalui lapisan semi permiabel. Ketika garam
ditaburi ke tubuh lintah, maka pelarut akan berpindah ke larutan garam, maka
lintah akan kering dan mati. Jadi
ketika Anda menabur garam di tubuh lintah, garam tersebut akan larut di lendir
yang digunakan lintah untuk berjalan. Akhirnya jadilah sebuah larutan garam,
yang mana konsentrasi larutan garam di luar tubuh lintah lebih tinggi dibandingkan di dalam tubuh lintah.
51. Diketahui
gambar :
Berdasarkan ilustrasi di atas, apabila
spesi-spesi tersebut dibiarkan bereaksi, ilustrasi molekular yang membentuk
penyangga adalah..
(A) a
(B) b
(C) c
(D) a dan b
(E) a dan c
PEMBAHASAN : C
Ketika asam lemah direaksikan dengan basa kuat, maka
larutan penyangga akan terbentuk jika asam lemah dalam jumlah berlebih. Artinya
asam lemah bersisa. Maka dari ilustrasi di atas kita hanya menghitung jumlah
mol asam lemah (bulat kosong) harus lebih banyak dari jumlah mol basa kuat
(bulat hitam)
1. gambar a (Hidrolisis garam, asam lemah dan basa kuat habis bereaksi)
jumlah mol asam lemah = 0,6 mol
jumlah mol basa kuat = 0,6 mol
2. gambar b ( bersiifat basa, karena basa kuat berlebih)
jumlah mol asam lemah = 0,5 mol
jumlah mol basa kuat = 0,8 mol
3. gambar c (Penyangga / buffer / dapar)
jumlah mol asam lemah = 1,0 mol
jumlah mol basa kuat = 0,3 mol
52. Sebanyak 25 mL larutan metilamina (CH3NH2)
0,040 M (Kb CH3NH2 = 4,0 × 10-4) dititrasi
dengan larutan asam kuat HCl 0,020 M. Setelah penambahan 55 mL HCl, campuran
diencerkan dengan air sampai 100 mL. Maka pH larutan hasil pengenceran ini
adalah…
(A) 2
(B) 5
(C) 3
(D) 6
(E) 4
PEMBAHASAN : C
mmol CH3NH2 = 25
x 0,04 = 1 mmol
mmol HCl = 55 x 0,02 = 1,1 mmol
CH3NH2 +
HCl → CH3NH3Cl
M : 1 1,1 -
B : 1 1 1
S : - 0,1 1
Karena yang tersisa adalah HCl maka penentu sifat
adalah asam.
[H+] = Ma x a
[H+] = mmol/vol x a
[H+] = 0,1/100 x 1
[H+] = 10-3
pH = - log 10-3
pH = 3
53. Molekul SF6 mempunyai enam domain pasangan elektron di
sekitar atom pusat S dengan domain
berupa pasangan elektron ikatan sebanyak enam. Geometri molekul SF6
dalah…[16S, 9F]
(A) Planar
segitiga
(B) Bentuk T
(C) Piramida
segiempat
(D) Piramida
segitiga
(E) Oktahedral
PEMBAHASAN : E
PEI
|
PEB
|
RAMALAN
|
BENTUK
|
2
|
-
|
AX2
|
Linier
|
3
|
-
|
AX3
|
Segitiga
datar/ planar
|
2
|
1
|
AX2E
|
Bentuk V
|
4
|
-
|
AX4
|
Tetrahedral
|
3
|
1
|
AX3E
|
Segitiga
piramida
|
2
|
2
|
AX2E2
|
Bentuk V
(bengkok) / bent
|
5
|
-
|
AX5
|
Segitiga
bipiramida
|
4
|
1
|
AX4E
|
Seesaw /
jungkat-it
|
3
|
2
|
AX3E2
|
Bentuk T
|
2
|
3
|
AX2E3
|
Linier
|
6
|
-
|
AX6
|
Oktahedral
|
5
|
1
|
AX5E
|
Segiempat
piramida
|
4
|
2
|
AX4E2
|
Segiempat
datar /bujur sangkar
|
Untuk senyawa SF6, atom pusat adalah S
dengan nomor atom 16
16S = 2-8-6. Electron valensi S adalah 6 sehingga PEI
= 6, dan PEB tidak ada, dengan bentuk AX6 (OKTAHEDRAL)
54. Suatu sampel diketahui mengandung campuran garam-garam aluminium,
tembaga, magnesium, perak dan natrium. Sampel tersebut dilarutkan ke dalam asam
nitrat pekat sehingga semua logam terlarut sempurna sebagai kation. Jika ke dalam
larutan kemudian ditambahkan larutan HCl 2,0 M secara perlahan-lahan, kation
yang akan mengendap sebagai garam kloridanya adalah…
(A) Al3+
(B) Ag+
(C) Cu2+
(D) Na+
(E) Mg2+
PEMBAHASAN : B
Tabel kelarutan
beberapa kation terhadap anion :
Senyawa
|
Kelarutan
|
Kecuali
|
Asam
|
Larut
|
H2S,
H2SiO3
|
Basa
|
Tidak
larut
|
Alkali,
Ca, Sr, Ba
|
Garam
alkali dan ammonium
|
Larut
|
-
|
Garam
fluorida, nitrat, asetat, klorat, bromat, iodat
|
Larut
|
-
|
Garam
nitrit
|
Larut
|
AgNO2
|
Garam
klorida, bromida, iodida
|
Larut
|
AgX,
PbX2, Hg2X2
|
Garam
sulfat, kromat
|
Larut
|
PbX,
SrX, BaX
|
Garam
sulfida
|
Tidak
larut
|
Alkali,
alkali tanah, ammonium
|
Garam
karbonat, sulfat, fosfat, fosfit
|
Larut
|
Alkali,
ammonium
|
Garam-garam yang
mengandung logam Al, Cu, Mg, Ag, dan Na dicampr dengan HNO3 pekat
hingga membentuk ion logam masing masing yaitu : Al3+, Cu2+,
Mg2+, Ag+, Na+. maka kation yang membentuk
endapan dengan asam klorida atau garam klorida adalah AgCl
55. Oksidasi ion sulfit (SO32-) dapat dilakukan dengan
menggunakan ion permanganat (MnO4-)
menurut reaksi berikut : 6H+ + 5𝑆𝑂32- + 2𝑀𝑛O4-
→ 5𝑆O42- + 2𝑀n2+ + 3𝐻2𝑂
Dalam suatu reaksi digunakan
100 ml larutan H2SO3 0,10 M dengan 100 ml Larutan KMnO4
yang di dapat dari pengenceran 5 mL larutan KMnO4 2,0 M. Konsentrasi
Mn2+ yang diperoleh dalam campuran reaksi tersebut adalah…
(A) 0,01 M
(B) 0,10 M
(C) 0,02 M
(D) 0,20 M
(E) 0,05 M
PEMBAHASAN : C
mmol H2SO3 = 100 x 0,1 = 10 mmol
mmol KMnO4 = 5 x 2 = 10 mmol
H2SO3 →2H+
+ SO32-
10 mmol 10 mmol
KMnO4 →K+ + MnO4-
10 mmol 10 mmol
6H+ + 5𝑆𝑂32- + 2𝑀𝑛O4- → 5𝑆O42- + 2𝑀n2+ + 3𝐻2𝑂
M
- 10 10 - - -
B 12 10 4 10 4 6
S 12 - 6 10 4 6
[Mn2+] = 4/200 = 0,02 M
56. Hidrolisis N-metil asetamida akan menghasilkan produk utama
berupa…
(A) Metanol dan asetamida
(B) Metilasetat dan ammonia
(C) Metana dan asetilamina
(D) Metilkarbinol dan etilamina
(E) Metilamina dan asam metilkarboksilat
PEMBAHASAN :
O O
// //
CH3-C-NH-CH3 + H2O
→ CH3-C-OH + CH3-NH2
Bacaan 57-59
Fenol C6H5OH
merupakan asam lemah dengan Ka = 10-10. Sebanyak 30 mL larutan fenol
0,1 M dititrasi dengan larutan NaOH 0,1 M, nilai pH dalam labu titrasi
dimonitor dengan pH meter. Setelah penambahan 15 mL NaOH ,
campuran larutan dalam labu titrasi diencerkan dengan H2O murni
hingga volume 100 mL.
57. pH larutan fenol sebelum titrasi adalah…
(A) 1
(B) 5,5
(C) 2,5
(D) 10
(E) 4
PEMBAHASAN : B
[H+] = √ka x Mb
[H+] = √10-10 x 10-1
[H+] = 10-5,5
pH = - log 10-5,5
pH = 5,5
58. Setelah penambahan 10 mL larutan NaOH, konsentrasi natrium fenolat
dalam larutan pada labu titrasi menjadi…
(A) 0,001
(B) 0,025
(C) 0,040
(D) 0,050
(E) 0,100
PEMBAHASAN : B
mmol C6H5OH = 30 x 0,1 = 3 mmol
mmol NaOH = 10 x 0,1 = 1 mmol
Keadaan
|
C6H5OH
|
+
|
NaOH
|
→
|
C6H5ONa
|
+
|
H2O
|
M
|
3 mmol
|
1 mmol
|
-
|
-
|
|||
B
|
1 mmol
|
1 mmol
|
1 mmol
|
1 mmol
|
|||
S
|
2 mmol
|
-
|
1
mmol
|
1 mmol
|
[C6H5ONa]
= mmol/vol total = 1/40 = 0,025 M
59. pH larutan dalam labu titrasi setelah penambahan 15 mL NaOH dan
pengenceran…
(A) 1,5
(B) 8,5
(C) 4
(D) 10
(E) 5
PEMBAHASAN : D
mmol NaOH = 15 x 0,1 = 1,5 mmol
Keadaan
|
C6H5OH
|
+
|
NaOH
|
→
|
C6H5ONa
|
+
|
H2O
|
M
|
3 mmol
|
1,5 mmol
|
-
|
-
|
|||
B
|
1,5 mmol
|
1,5 mmol
|
1,5 mmol
|
1,5 mmol
|
|||
S
|
1,5
mmol
|
-
|
1,5 mmol
|
1,5 mmol
|
Karena yang tersisa adalah asam lemah maka
yang kita gunakan adalah rumus penyangga.
[H+] = ka x (mol asam / mol
garam x val)
[H+] = 10-10 x
(1,5/1,5)
[H+] = 10-10
pH = - log 10-10 = 10
60. Cara sabun cuci menghilangkan kotoran pada
baju adalah…
(A) Menurunkan kesadahan air
(B) Membentuk ikatan hidrogen dengan minyak
(C) Molekul sabun bereaksi dengan air
(D) Menstabilkan emulsi minyak dalam air
(E) Bereaksi dengan kotoran
PEMBAHASAN : D
61. Logam Na, Ca, Mg, Zn dan Ag dimasukkan ke dalam larutan HCl pekat
kemudian ditambahkan padatan KOH. Logam yang lebih dulu mengendap adalah…
(A) Na
(B) Zn
(C) Ca
(D) Ag
(E) Mg
PEMBAHASAN : D
62. Sebuah sel Galvani tersusun dari elektroda grafit yang dicelupkan
ke dalam larutan KMnO4 dalam suasana asam dan elektroda Zn yang
dicelupkan dalam larutan Zn(NO3)2. Jika sel tersebut
dioperasikan, pernyataan yang benar adalah…(E0 Zn2+| Zn =
-0,76 V dan MnO4- | Mn2+= 1,49 V)
1)
pH
larutan Zn(NO3)2 bertambah
2)
pH
larutan KMnO4 berkurang
3)
elektron
mengalir dari elektroda grafit ke elektroda Zn
4)
konsentrasi
ion Zn2+ bertambah
63. di bawah ini menunjukkan fenomena yang dapat diamati dalam
kehidupan sehari-hari. Dari fenomena berikut, yang tidak menunjukkan sifat koligatif
adalah…
1)
Titik
beku air menurun ketika ditambahkan garamnya.
2)
Lobster
akan mati jika disimpan dalam air tawar
3)
Zat
anti beku ditambahkan ke dalam radiator untuk menjaga mesin mobil agar tetap
dingin.
4)
Pada
daerah pegunungan, waktu untuk memasak spageti menjadi lebih lama.
64. Di antara pernyataan berikut yang menunjukkan sifat koligatif
adalah…
1)
Larutan
NaBr 0,5 M mempunyai tekanan yang lebih tinggi daripada larutan BaCl2
0,5 M
2)
Air
membeku pada suhu yang lebih tinggi daripada metanol
3)
NaOH
0,5 M membeku pada suhu yang lebih rendah daripada air murni
4)
Larutan
CaCl2 mempunyai tekanan osmotik lebih rendah daripada larutan NaCl
65. Selulosa dihidrolisis jadi dimer membentuk…
(A) Sukrosa
(B) Laktulosa
(C) Laktosa
(D) Maltosa
(E) Selobiosa
66. Tekanan udara di pinggir pantai adalah 760 mmHg, sedangkan di
puncak everest yang memiliki ketinggian 8900 m di atas permukaan laut tekanan
udara berkisar 240 mmHg. Manakah yang lebih cepat matang, merebus telur di
puncak everest atau di pinggir pantai?
(A) Puncak everest karena air mendidih lebih cepat
(B) Puncak everest karena air mendidih pada suhu
tinggi
(C) Pinggir pantai karena air mendidih lebih
cepat
(D) Pinggir pantai karena air mendidih pada suhu
lebih tinggi
(E) Matang secara bersamaan karena air sama-sama
mendidih
67. Atom
pusat Br molekul BrF5 dikelilingi oleh 6 domain pasangan elektron,
yaitu 5 domain merupakan pasangan elektron ikatan dan 1 domain pasangan
elektron bebas yang tidak diberikan. Geometri molekul BrF5 adalah..
(A) Piramida segiempat
(B) Planar
segiempat
(C) Trigonal
bipiramida
(D) Piramida
segilima
(E) Piramida
segitiga
PEMBAHASAN : A
PEI
|
PEB
|
RAMALAN
|
BENTUK
|
2
|
-
|
AX2
|
Linier
|
3
|
-
|
AX3
|
Segitiga
datar/ planar
|
2
|
1
|
AX2E
|
Bentuk V
|
4
|
-
|
AX4
|
Tetrahedral
|
3
|
1
|
AX3E
|
Segitiga
piramida
|
2
|
2
|
AX2E2
|
Bentuk V
(bengkok) / bent
|
5
|
-
|
AX5
|
Segitiga
bipiramida
|
4
|
1
|
AX4E
|
Seesaw /
jungkat-it
|
3
|
2
|
AX3E2
|
Bentuk T
|
2
|
3
|
AX2E3
|
Linier
|
6
|
-
|
AX6
|
Oktahedral
|
5
|
1
|
AX5E
|
Segiempat
piramida
|
4
|
2
|
AX4E2
|
Segiempat
datar /bujur sangkar
|
Maka bentuk AX5E : segiempat piramida
68. Penambahan
toluena ke dalam bensin bebas timbal bertujuan untuk...
(A) Menurunkan
tekanan uap bensin
(B) Meningkatkan
viskositas bensin
(C) Meningkatkan titik nyala bensin
(D) Menurunkan
titk didih bensin
(E) Meningkatkan
tingkat oksidasi bensin
PEMBAHASAN : C
69.
diketahui :
Dia digram di atas menunjukkan perubahan
konsentrasi pada reaksi kesetimbangan antara A, B dan C pada temperatur
tertentu. Reaksi kesetimbangan yang terjadi adalah...
(A) A + B ⇌ 2C
(B) 2A ⇌ C + B
(C) A +
2B ⇌ 3C
(D) 2A + B ⇌2C
(E) 3C + B ⇌ 2A
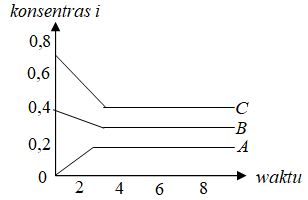
PEMBAHASAN : E
Reaktan : grafik yang turun
Produk : grafik yang naik
Berarti :
B + C ⇌ A
Perubahan konsentrasi masing masing zat kita anggap
sebagai koefisien
(0,4-0,3)B + (0,7-0,4)C ⇌ (0,2-0)A
0,1B + 0,3C ⇌ 0,2A
B + 3C ⇌ 2A
70. Paku
besi lebih cepat berkarat jika berada pada lingkungan yang lembab karena...
(A) Bereaksi
dapat bereaksi dengan air dan menghasilkan besi hidroksida
(B) Besi lebih mudah bereaksi dengan oksigen pada lingkungan yang lembab
(C) Kotoran
yang menempel pada permukaan besi larut dalam air
(D) Besi
lebih mudah tereduksi pada lingkungan yang lembab
(E) Uap air
pada permukaan besi dapat berfungsi sebagai medium tumbuhnya bakteri yang
menyebabkan korosi
PEMBAHASAN : B
Beberapa faktor yang mempercepat perkaratan besi :
1. Adanya air (lingkungan lembab)
2. Adanya asam
3. Adanya garam
4. Adanya basa
5. Permukaan besi yang tidak rata
6. Zat terlarut yang dapat membentuk oksidasa asam (SO2)
UNTUK SOAL 74-76
Sebanyak 20 ml larutan hidrazin 0,02 M ( kb N2H4
= 2.10-6 ) dititrasi dengan larutan HCl 0,01 M
71. pH
larutan hidrazin sebelum titrasi adalah...
(A) 4 – log
2
(B) 6 – log
2
(C) 8 + 2
log 2
(D) 10 + log 2
(E) 10 + 2 log 2
PEMBAHASAN :
[OH-] = √kb x Mb
[OH-] = √2.10-6 x 2.10-2
[OH-] = 2 x 10-4
pOH = - log 2 x 10-4 = 4 – log 2
pH = 10 + log 2
72. pH
larutan setelah penambahan 20 ml HCl adalah
(A) 6 – log
2
(B) 6 – 2
log 2
(C) 7
(D) 8 + log 2
(E) 10 + log
2
PEMBAHASAN : D
mmol N2H4
= 20 x 0,02 = 0,4 mmol
mmol HCl = 20 x 0,01
= 0,2 mmol
Keadaan
|
N2H4
|
+
|
HCl
|
→
|
N2H5Cl
|
M
|
0,4 mmol
|
0,2 mmol
|
-
|
||
B
|
0,2 mmol
|
0,2 mmol
|
0,2 mmol
|
||
S
|
0,2
mmol
|
-
|
0,2 mmol
|
[OH-] = kb x mol basa/mol garam
[OH-] = 2.10-6 x 0,2/0,2
[OH-] = 2.10-6
pOH = - log 2.10-6 = 6 – log 2
pH = 8 + log 2
73. Pada
titik eqivalen (tepat saat penambahan 40 ml HCl) adalah. pH larutan adalah...
(A) Lebih kecil dari 7
(B) Lebih
besar dari 7
(C) Sama dengan 7
(D) Sama
dengan pKb N2H4
(E) Sama
dengan pKa H2N-NH3+
PEMBAHASAN : A
mol HCl = 40 x 0,01 = 0,4 mol
Keadaan
|
N2H4
|
+
|
HCl
|
→
|
N2H5Cl
|
M
|
0,4 mmol
|
0,4 mmol
|
-
|
||
B
|
0,4 mmol
|
0,4 mmol
|
0,4 mmol
|
||
S
|
-
|
-
|
0,4 mmol
|
Karena yang tersisa hanya garam ( asam dan basa telah
habis bereaksi sempurna), maka terjadi hidrolisis garam bersifat asam. Maka pH
garamnya akan berada di bawah 7
74. Reaksi
yang dapat digunakan untuk membuat asam asetat adalah...
(A) Hidrolisis
etil asetat
(B) Hidrolisis
asetilamina
(C) Oksidasi
etanol
(D) Oksidasi
isopropanol
(E) Oksidasi
asetaldehid
PEMBAHASAN :
75. Perhatikan
reaksi di bawah ini
Cu + H+ → tidak
bereaksi
Pb + 2H+ → Pb2+
+ H2
Pb + H2O → tidak
bereaksi
Ca + 2H2O → Ca2+
+ H2 + 2OH-
Berdasarkan reaksi di atas, urutan kereaktifan
(A) Ca >
Cu > Pb
(B) Pb >
Ca > Cu
(C) Pb >
Cu > Ca
(D) Cu >
Pb > Ca
(E) Ca > Pb > Cu
PEMBAHASAN : E
DERET
VOLTA
Deret Volta adalah urutan logam-logam berdasarkan
kenaikan potensial reduksi (E0)
Li-K–Ba–Ca–Na–Mg–Al–Mn–H2O-Zn–Cr–Fe–Cd
Co–Ni - Sn–Pb–(H)–Sb–Bi–Cu–Hg–Ag-Pt-Au
Prinsip Susunan Logam sebagai berikut :
================================================================>
Kiri H (Eo negatip) Kanan H
(Eo positif)
H
Nilai E0 - - - - - - - -
- - - - - - - - - - - - - - (0) + + + + + + + + + + + + + +
Eo
kecil Eo besar
Reduktor
Kuat
Reduktor
Lemah
Mudah
Teroksidasi Sukar
Teroksidasi
Arti
Deret Volta:
1. Logam
yang memiliki Eo lebih
positip cenderung mengalami reduksi
dalam reaksinya. Sedangkan logam yang memiliki Eo lebih negatif mengalami oksidasi.
2. Logam
yang berada di kiri H2O bereaksi dengan H2O membentuk
senyawa basa dan H2
3. Logam
yang berada di kiri H bereaksi dengan Asam non oksidator membentuk senyawa
garam dan H2
4. Logam
yang berada di kiri dapat mereduksi logam di sebelah kanannya
5. Aliran
electron berasal dari anoda ke katoda
6. Makin ke kanan makin kurang reaktif
JADI :
Cu + H+ → tidak
bereaksi :
H dikiri Cu
Pb + 2H+ → Pb2+
+ H2 : Pb dikiri H
Pb + H2O → tidak bereaksi : H2O
dikiri Pb
Ca + 2H2O → Ca2+
+ H2 + 2OH- : Ca dikiri H2O
Urutan makin ke kanan (E0 makin besar/
kereaktifan turun): Ca – H2O – Pb – H – Cu
76. Biokatalis
yang digunakan dalam penjernihan jus buah dan sayuran di beberapa industri
minuman adalah...
(A) Amilase
(B) Lipase
(C) Laktase
(D) Selulase
(E) Protease
77. Disediakan
tabel :
Nomor
atom
|
Simbol
|
Nomor
massa
|
13
|
P
|
27
|
14
|
Q
|
28
|
15
|
R
|
31
|
16
|
S
|
32
|
17
|
T
|
35
|
Unsur yang dapat mempunyai bilangan oksidasi +7
dalam senyawanya adalah...
(A) P
(B) Q
(C) R
(D) S
(E) T
PEMBAHASAN :
·
Untuk logam
Bilangan oksidasi
minimum adalah nol (unsur bebasnya) sedangkan bilangan oksidasi maksimum dari
golonganya
·
Untuk unsur non logam
Bilangan
oksidasi minimum diambil dari golongan dikurangi delapan, sedangkan bilangan
oksidasi maksimum diambil dari golonganya
Maka :
13P : 2 – 8 – 3
14Q : 2 – 8 – 4
15R : 2 – 8 – 5
16S : 2 – 8 – 6
17T : 2 – 8 – 7
78. Diketahui
gambar :
Pernyataan yang benar dari gambar di
atas adalah
(A) A + B
bisa langsung membentuk P
(B) A + B membentuk P melalui dua kompleks teraktifasi yaitu AB* dan C*
(C) Reaksi A
+ B membentuk P melepaskan energi sebesar E – F
(D) Reaksi A
+ B membentuk P melepaskan energi sebesar F – D
(E) Reaksi A
+ B membentuk C adalah reaksi eksoterm
PEMBAHASAN : B
79. Perhatikan
gambar berikut !
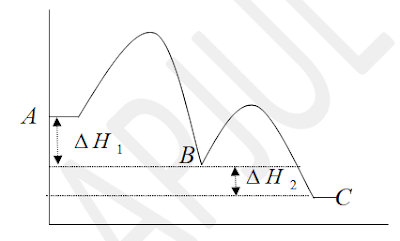
∆H1 = ∆H2 = - 410
kJ
Proses yang menjadi tahap penentu laju
reaksi adalah
(A) Proses
endoterm dari A ke B
(B) Proses eksoterm dari A ke B
(C) Proses
eksoterm dari B ke C
(D) Proses
endoterm dari B ke C
(E) Proses
eksoterm dari A ke C
PEMBAHASAN : B
Tahap penentu reaksi dapat kita lihat dari reaksi
paling lambat ( energi aktifasi paling besar ) yaitu reaksi dari A ke B.
sedangkan dari B ke C memiliki energy aktifasi yang lebih kecil








Alkohol,eter,aldehide,keton,dll itu gak msk utkbk kahh??
BalasHapusDi tahun 2019 soal tentang senyawa organik ada. Alkohol, eter, aldehid, asam alkanoat, ester. Semua reaksi organik makromolekul itu adalah topik kimia organik. Nah di UTBK 2019, ada soal yang kluar entang reaksi organik. Di soal no 56.
HapusTapi saya berharap semua topik yg dipelajari harus dipahami semua. Karena di UTBK 2019 agak berbeda dengan ujian masuk PTN sebelumnya. Terima kasih